
數(shù)據(jù)非依賴性的掃描模式(Date-independent acquisition,DIA)是近幾年發(fā)展的一種新的質(zhì)譜數(shù)據(jù)采集方式。在肽段進(jìn)入質(zhì)譜進(jìn)行第一次m/z掃描后,所有選定m/z范圍內(nèi)的母離子全部碎裂,然后在串聯(lián)質(zhì)譜中進(jìn)行子離子的第二次m/z掃描。根據(jù)第一次m/z掃描得到母離子的峰強(qiáng)度信息,只選擇幾個(gè)信號(hào)強(qiáng)度最高的母離子進(jìn)行碎裂,選擇性的采集會(huì)帶來檢測(cè)的隨機(jī)性和不完整性。DIA相較于DDA技術(shù)定量的特異性高,定量精度更高,更好的重現(xiàn)性;更適合于大樣本量定量蛋白質(zhì)組。
技術(shù)優(yōu)勢(shì)
(1)更符合樣本真實(shí)蛋白表達(dá)結(jié)果:更全面和權(quán)威的數(shù)據(jù)庫和軟件,同一樣本能鑒定到更多的蛋白質(zhì)種類;
(2)更專業(yè)的生信團(tuán)隊(duì),具有多年的蛋白組學(xué)分析經(jīng)驗(yàn),能提供各種個(gè)性化的高級(jí)分析。
技術(shù)流程
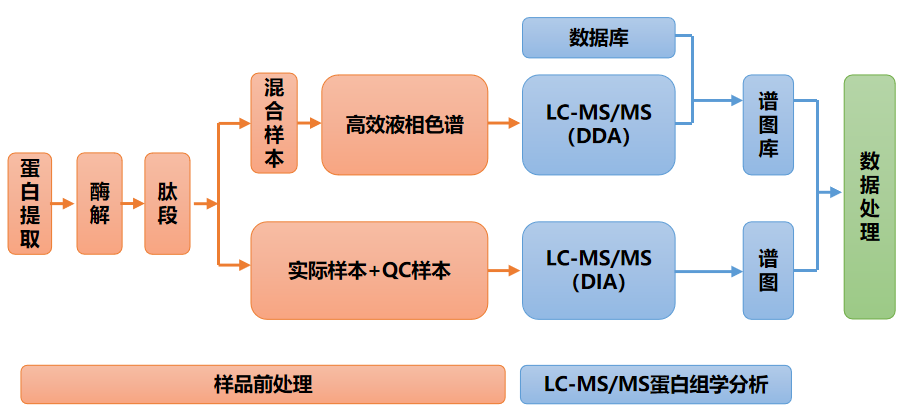
信息分析
生信分析總流程
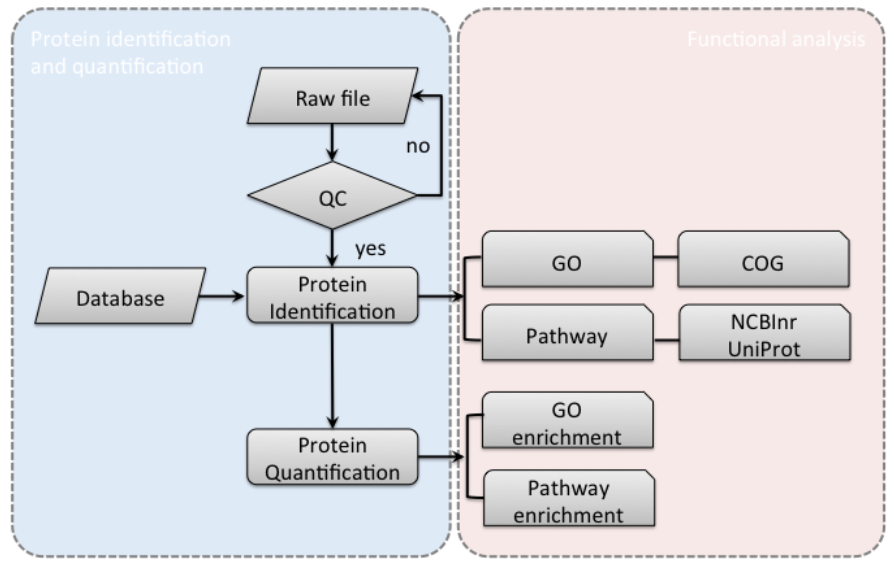
標(biāo)準(zhǔn)信息分析
(1)數(shù)據(jù)質(zhì)控
主成分分析
譜圖信息
蛋白質(zhì)定量
(2)定性
蛋白GO/Pathway注釋分析
蛋白KOG/COG注釋分析
蛋白亞細(xì)胞定位
TF預(yù)測(cè)
(3)定量
相關(guān)性分析
強(qiáng)度箱線圖分析
(4)差異及富集分析
差異蛋白KOG/COG富集分析
差異蛋白GO/Pathway富集分析
分析結(jié)果示例

蛋白強(qiáng)度密度箱線圖
蛋白強(qiáng)度轉(zhuǎn)換熱圖
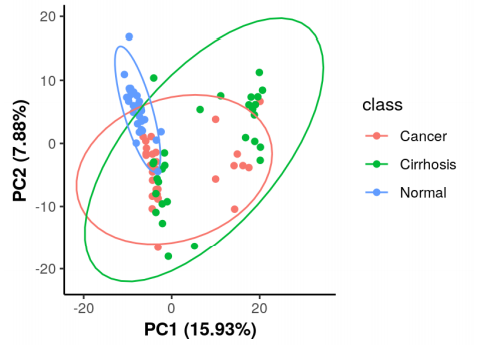
PCA圖

蛋白亞細(xì)胞定位統(tǒng)計(jì)圖
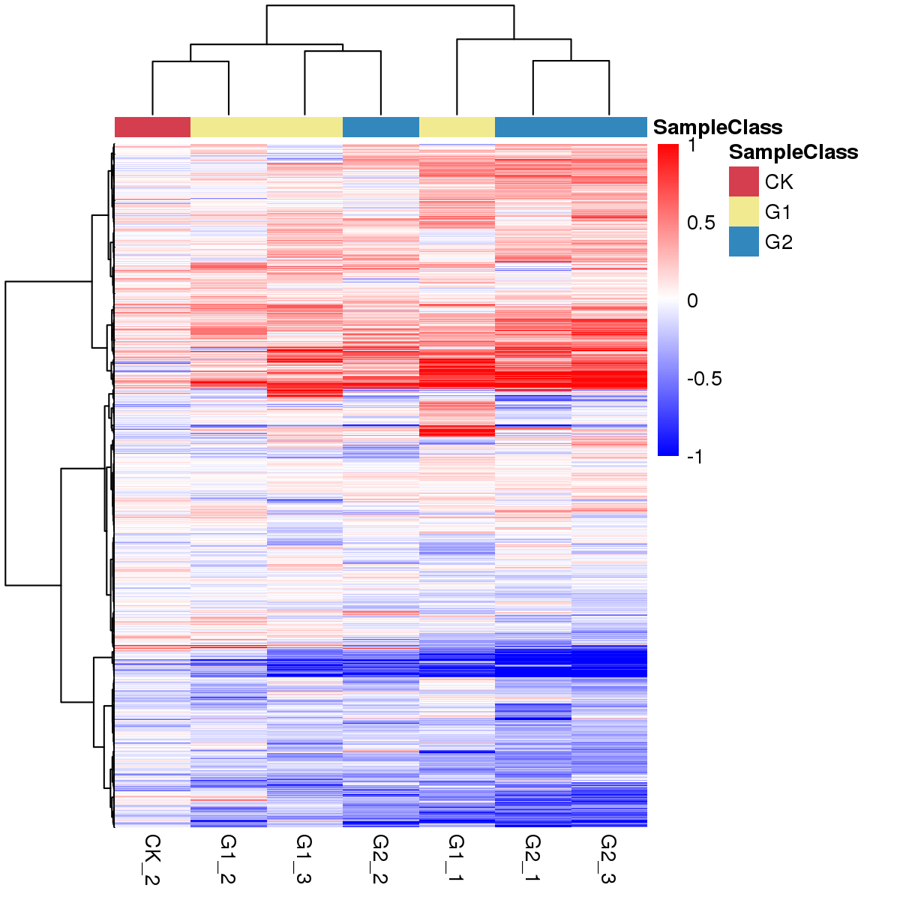
差異蛋白熱圖

差異蛋白火山圖
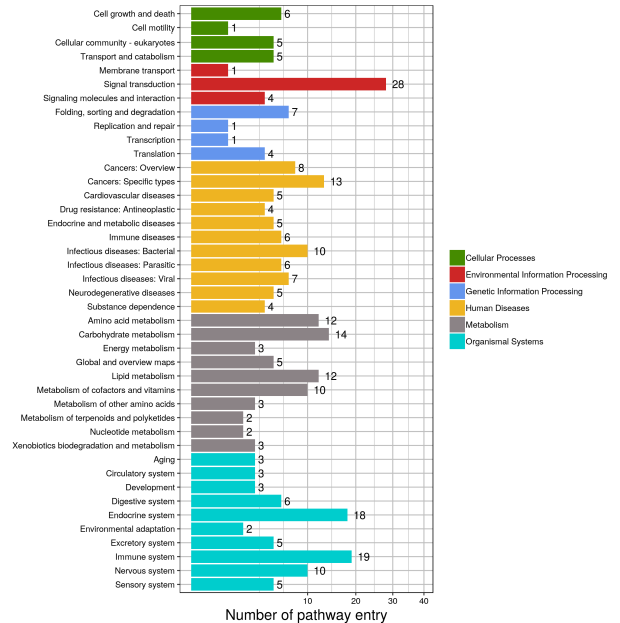
pathway分類條形圖

GO功能分類條形圖
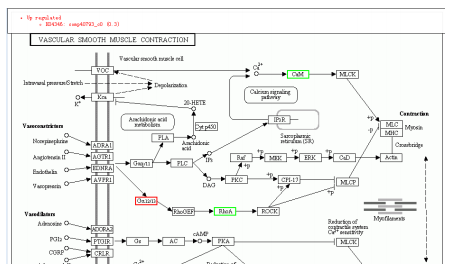
差異蛋白參與代謝通路圖
案例分析
案例(1)HSCC化療多藥耐藥分子標(biāo)記:高通量液相色譜-串聯(lián)質(zhì)譜蛋白質(zhì)組學(xué)篩選
本研究采用液相色譜-串聯(lián)質(zhì)譜LC-MS對(duì)50例下咽鱗狀細(xì)胞癌(HSCC)臨床樣本進(jìn)行DIA蛋白組學(xué)篩選,并在HSCC樣本中共鑒定出673個(gè)差異表達(dá)蛋白,其中172個(gè)上調(diào),501個(gè)下調(diào)。臨床 HSCC 樣本的 FADD 表達(dá)顯著升高,RIPK1 表達(dá)顯著降低。化療敏感組FADD和RIPK1蛋白的表達(dá)明顯降低。揭示出FADD 和 RIPK1 可作為 HSCC 患者化療 MDR 的分子標(biāo)志物,可能通過壞死性凋亡和 PRR 信號(hào)通路發(fā)揮作用。

圖1 差異蛋白熱圖

圖2 差異蛋白富集分析柱狀圖

圖3 差異蛋白PPI圖
案例(2)ACOX2作為肝細(xì)胞癌的預(yù)后標(biāo)志物,可通過PPARα通路阻礙肝細(xì)胞癌的進(jìn)展
本研究通過對(duì)24對(duì)人類肝癌和癌旁組織進(jìn)行DIA蛋白組學(xué)篩選,探索ACOX2在肝癌中的作用機(jī)制。結(jié)果顯示,1029種蛋白質(zhì)具有顯著差異,且將這些顯著差異蛋白質(zhì)與癌癥基因圖譜中差異表達(dá)基因進(jìn)行比較、在蛋白質(zhì)-蛋白質(zhì)相互作用進(jìn)行分析,發(fā)現(xiàn)ACOX2作為關(guān)鍵候選基因,其過表達(dá)并通過PPARα通路減少了肝癌在體外和體內(nèi)的增殖和轉(zhuǎn)移阻礙肝癌的發(fā)展。
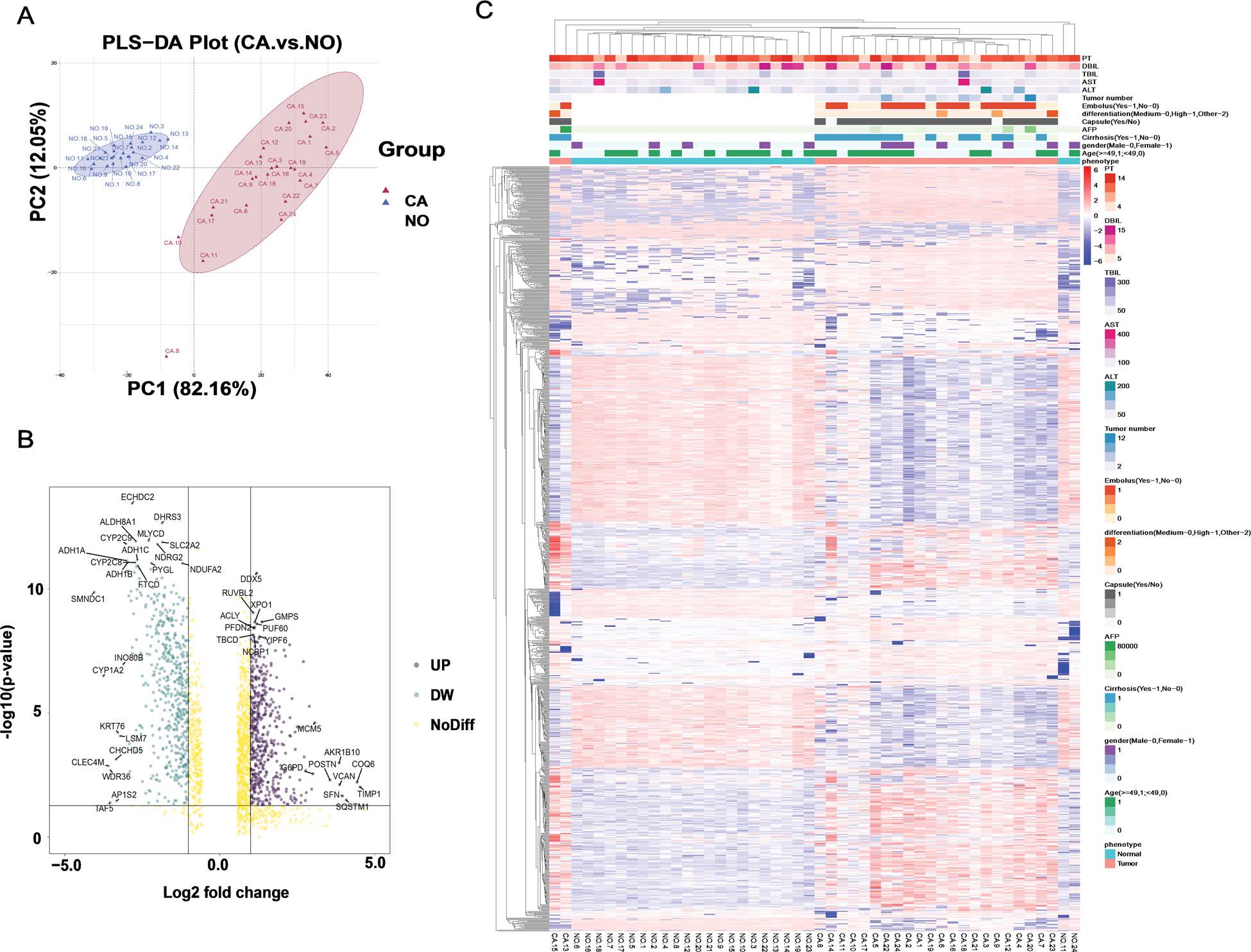
圖4 A:肝細(xì)胞癌和配對(duì)的相鄰正常樣本中蛋白質(zhì)表達(dá)的OPLS-DA 分析;B:顯著表達(dá)差異蛋白火山圖;C:差異表達(dá)蛋白聚類熱圖
[1] Shen B, Dong X, Yuan B, et al. Molecular Markers of MDR of Chemotherapy for HSCC: Proteomic Screening With High-Throughput Liquid Chromatography-Tandem Mass Spectrometry[J]. Frontiers in Oncology, 2021, 11:687320.
[2] Zhang Q, Zhang Y, Sun S, et al. ACOX2 is a prognostic marker and impedes the progression of hepatocellular carcinoma via PPARα pathway[J]. Cell Death & Diseas